ഈ പ്രപഞ്ചത്തില് ഉള്ള എല്ലാ പദാര്ത്ഥങ്ങളും നിര്മ്മിക്കപ്പെട്ടിരിക്കുന്നത് അണുക്കളാലാണെന്നു പറയാം . ഒരു കെട്ടിടം നിര്മ്മിക്കുന്നത് ഇഷ്ടികകള് കൊണ്ടോ അല്ലെങ്കില് സിമന്റ് കട്ടകള് കൊണ്ടോ ആണല്ലോ . അതേപോലെ നാം
കാണുന്ന എന്തും , നമ്മുടെ ശരീരം തന്നെയും അണുക്കള് ചേര്ത്ത് വെച്ച് ഉണ്ടായതാണ് . ഈ ഭൂമിയും, ആകാശവും , വെള്ളവും , വായുവും , കരിയും പുകയും എല്ലാം അണുക്കള് തന്നെ. ഏതൊരു പദാര്ത്ഥത്തെയും
ചെറിയ കണങ്ങള് ചേര്ന്നാണു വലിയ വലിയ വസ്തുക്കള് ഉണ്ടായതെന്ന് പുരാതനകാലം മുതലേ മനുഷ്യന് മനസ്സിലാക്കിയിരുന്നു. ഉദാഹരണത്തിന് പര്വ്വതത്തെ നോക്കാം , അത് ചെറിയ മണ്തരികള് ചേര്ന്ന് ഉണ്ടായതാണ്
മഹാസമുദ്രങ്ങള് നഗ്നനേത്രം കൊണ്ട് കാണാന് കഴിയാത്ത ജലകണങ്ങള് ചേര്ന്ന് ഉണ്ടായതാണ്. ഒരു അണുവിനെ നമുക്ക് നമ്മുടെ കണ്ണ് കൊണ്ട് കാണാന് കഴിയില്ല . ഇങ്ങിനെ നോക്കിയാല് അണുക്കളല്ലാതെ മറ്റൊന്നും
പ്രപഞ്ചത്തിലില്ല എന്ന് മനസ്സിലാക്കാന് കഴിയും . 90 ഓളം അണുക്കള് കൊണ്ടാണ് ഈ കാണുന്ന സര്വ്വതും ഉണ്ടായിട്ടുള്ളത് . 25-ലധികം അണുക്കള് ശാസ്ത്രജ്ഞന്മാര് പരീക്ഷണശാലകളില് കൃത്രിമമായി നിര്മ്മിച്ചിട്ടുണ്ട് .
ഏത് പദാര്ത്ഥത്തെയും ചെറുതാക്കാന് പറ്റുമെന്നു പറഞ്ഞല്ലോ , അങ്ങിനെ ചെറുതാക്കിയാല് ഇനിയും ചെറുതാക്കാന് പറ്റാത്ത ഒരവസ്ഥ വരും . അങ്ങിനെ അവിഭാജ്യമായത് എന്ന അര്ത്ഥത്തിലാണ് ആറ്റം എന്ന പേര്
അണുവിന് കൈവന്നത് . എന്നാല് പിന്നീട് ഏറ്റവും ചെറുത് അണുവല്ല , അണുവിനെയും പിളര്ക്കാം എന്ന് കണ്ടെത്തി . അങ്ങിനെ അണുവിനെ പിളര്ന്നാല് ലഭിക്കുന്ന അപരിമിതമായ ഊര്ജ്ജമാണ് ഇന്ന് ഏറെ ചര്ച്ച
ചെയ്യപ്പെടുന്ന ആണവോര്ജ്ജം . അണുക്കള് പ്രോട്ടോണ്, ന്യൂട്രോണ്, ഇലക്ട്രോണ് എന്നിങ്ങനെ വീണ്ടും പിളര���ക്കാന് കഴിയാത്ത മൂന്ന് കണങ്ങള് ചേര്ന്നതാണെന്ന് കണ്ടെത്തി . ഇതില് ഇലക്ട്രോണിന്റെ കണ്ടുപിടുത്തമാണ്
മനുഷ്യന് കൈവരിച്ച സര്വ്വ പുരോഗതിയുടേയും അടിസ്ഥാനം . എന്നാല് ന്യൂട്രോണും പ്രോടോണും ക്വാര്ക്കുകള് എന്ന ചെറുകണങ്ങള് ചേര്ന്നതാണെന്ന് പിന്നീട് കണ്ടെത്തി. എന്നാലും മനസ്സിലാക്കുന്നതിന്റെ സൌകര്യത്തിന്
വേണ്ടി; എലക്ട്രോണ് , പ്രോട്ടോണ്, ന്യൂട്രോണ് എന്നിങ്ങനെ മൂന്ന് അടിസ്ഥാനകണങ്ങള് ചേര്ന്നതാണ് ഒരു ആറ്റം എന്നു പറയാം.
അണുവിന്റെ മദ്ധ്യഭാഗത്ത് അതിന്റെ മര്മ്മഭാഗം അഥവാ ന്യൂക്ലിയസ്സ് സ്ഥിതിചെയ്യുന്നു. പ്രോട്ടോണും ന്യൂട്രോണും ചേര്ന്നതാണ് ന്യൂക്ലിയസ്സ്. ഇതില് പ്രോട്ടോണിന് വൈദ്യുതപരമായി പൊസിറ്റീവ് ചാര്ജ്ജ് ഉണ്ട് . ന്യൂട്രോണിന്
ഒരു ചാര്ജ്ജും ഇല്ല. അതായത് അണുവിന്റെ ന്യൂക്ലിയസ്സിനു പൊസിറ്റീവ് ചാര്ജ്ജ് ആണു. അണുവിലുള്ള ഇലക്ട്രോണ് അതിലുള്ള ന്യൂക്ലിയസ്സിനെ ചുറ്റി സദാ ഭ്രമണം ചെയ്യുന്നു . ഇലക്ട്രോണിന് നെഗറ്റീവ് ചാര്ജ്ജ് ആണ് .
അപ്പോള് പൊസിറ്റീവ് ചാര്ജ്ജുള്ള പ്രോട്ടോണും , ചാര്ജ്ജ് ഇല്ലാത്ത ന്യൂട്രോണും നെഗറ്റീവ് ചാര്ജ്ജുള്ള ഇലക്ട്രോണും ചേര്ന്നുള്ള ഒരാറ്റത്തിന് അഥവാ അണുവിന് വൈദ്യുത ചാര്ജ്ജ് ഇല്ല എന്നു പറയാം . അതായത് ഒരു
അണുവിന്റെ ന്യൂക്ലിയസ്സില് എത്ര പ്രോട്ടോണുകള് ഉണ്ടോ അത്രയും ഇലക്ട്രോണുകള് അതിന്റെ ന്യൂക്ലിയസ്സിനെ ചുറ്റി ഭ്രമണം ചെയ്യുന്നുണ്ടെങ്കില് ആ ആറ്റം ന്യൂട്രലാണ് .
ഏറ്റവും ചെറിയ അണുവായ ഹൈഡ്രജന് ആറ്റത്തില് ഒരു പ്രോട്ടോണും ഒരു ഇലക്ട്രോണും മാത്രമെയുള്ളൂ . അതിന്റെ ന്യൂക്ലിയസ്സില് ന്യൂട്രോണ് ഇല്ല. രണ്ടാമത്തെ അണുവായ ഹീലിയത്തില് രണ്ട് പ്രോട്ടോണും, രണ്ട്
ന്യൂട്രോണും, രണ്ട് ഇലക്ട്രോണും ആണുള്ളത് . അണുവിലുള്ള പ്രോട്ടോണിന്റെയും ഇലക്ട്രോണിന്റെയും എണ്ണം എപ്പോഴു�� തുല്യമായിരിക്കും.പൊതുവെ ഈ പ്രപഞ്ചത്തില് ഉള്ള എല്ലാറ്റിനെയും നമുക്ക് രണ്ട് ഭാഗങ്ങളായി
തിരിക്കാം . ഒന്ന് പദാര്ത്ഥം രണ്ടാമത്തേത് ഊര്ജ്ജം (matter and energy). അതായത് നമ്മള് കാണുന്ന എല്ലാം തന്നെ പദാര്ത്ഥങ്ങളാണ് . ഈ പദാര്ത്ഥങ്ങളെല്ലാം ഉണ്ടായിരിക്കുന്നത് അണുക്കളാലും . പദാര്ത്ഥത്തെ ഊര്ജ്ജമായും
, ഊര്ജ്ജത്തെ പദാര്ത്ഥമായും മാറ്റാം . ഇങ്ങിനെ പദാര്ത്ഥം ഊര്ജ്ജമായും , ഊര്ജ്ജം പദാര്ത്ഥമായും അനവരതം പരിവര്ത്തനവിധേയമാവുന്നതാണ് നാം കാണുന്ന എല്ലാ പ്രാകൃതിക പ്രതിഭാസങ്ങള്ക്കും നിദാനം.
സാധാരണഗതിയില് പദാര്ത്ഥം മൂന്ന് അവസ്ഥകളില് സ്ഥിതി ചെയ്യുന്നു . അവ യഥാക്രമം ഖരം, ദ്രാവകം,വാതകം (SOLIDS, LIQUIDS, and GASES ) എന്നിങ്ങനെയാണ് . ഏതൊരു പദാര്ത്ഥത്തെയും ഒരു അവസ്ഥയില് നിന്ന്
മറ്റൊരു അവസ്ഥയിലേക്ക് മാറ്റാന് കഴിയും . ഇങ്ങിനെ പദാര്ത്ഥം മുന്ന് അവസ്ഥകളില് സ്ഥിതി ചെയ്യുന്നതിന്റെ ഒരു നല്ല ഉദാഹരണമാണ് വെള്ളം. നാലു ഡിഗ്രി സെന്റിഗ്രേഡില് വെള്ളം ദ്രാവകാവസ്ഥയിലും , പൂജ്യം
ഡിഗ്രിയില് അത് ഖരാവസ്ഥയിലും (ice), 100 ഡിഗ്രി സെന്റിഗ്രേഡില് വാതകാവസ്ഥയിലും (നീരാവി) ജലം സ്ഥിതിചെയ്യുന്നു. വെള്ളത്തിന്റെ ഏറ്റവും ചെറിയ കണത്തെ അതിന്റെ ഒരു തന്മാത്ര ( molecule) എന്നു പറയാം .
ഏത് പദാര്ത്ഥത്തിന്റെയും ഏറ്റവും ചെറിയ കണത്തെ അതിന്റെ തന്മാത്ര എന്നു പറയുന്നു. അതായത് ഒരു പദാര്ത്ഥത്തിന്റെ എറ്റവും ചെറിയ കണമായ അതിന്റെ തന്മാത്രയെ വീണ്ടും വിഭജിക്കുകയാണെങ്കില് ആ
പദാര്ത്ഥത്തിന് അതിന്റെ ഗുണം നഷ്ടപ്പെടുന്നു. ആറ്റത്തെ മൂലകം ( element) എന്ന് വിശേഷിപ്പിക്കാം .
അതായത് മൂലകങ്ങള് ചേര്ന്ന് തന്മാത്രകള് ഉണ്ടാവുന്നു . വെള്ളം എന്നു പറയുന്നത് ഹൈഡ്രജന്, ഒക്സിജന് എന്നീ മുലകങ്ങള് ചേര്ന്നതാണ് . ഒരു ജലതന്മാത്രയില് രണ്ട് ഹൈഡ്രജന് ആറ്റങ്ങളും ഒരു ഓക്സിജന് (H2O)
ആറ്റവുമാണുള്ളത്. നാം സാധാരണയായി ഉപയോഗിക്കുന്ന പഞ്ചസാരയുടെ (sucrose) ഏറ്റവും ചെറിയ കണമായ തന്മാത്രയില് 12 കാര്ബണ് ആറ്റങ്ങളും, 22 ഹൈഡ്രജനും , 11 ഓക്സിജന് (C12H22O11)
ആറ്റങ്ങളുമാണുള്ളത് . പഞ്ചസാര നമ്മുടെ ശരീരത്തിനുള്ളിലേക്ക് അതായത് രക്തത്തിലേക്ക് പ്രവേശിക്കണമെങ്കില് അത് ഗ്ലൂക്കോസ് തന്മാത്രകളായി (C12H12O6) വിഘടിക്കേണ്ടതുണ്ട് . ഇതേപ്പറ്റി പിന്നീട് പ്രതിപാദിക്കാം . ഒരു
പദാര്ത്ഥത്തിന്റെ തന്മാത്രയെ വിഭജിച്ചാല് കിട്ടുന്ന പുതിയ പദാര്ത്ഥത്തിന് തികച്ചും വ്യത്യസ്ഥമായ ഗുണമായിരിക്കും എന്ന് സൂചിപ്പിക്കാനാണ് പഞ്ചസാരയുടെ ഉദാഹരണം പറഞ്ഞത്.
ഒരു ആറ്റത്തിന്റെ ഘടനയെ നമ്മുടെ സൌരയൂഥത്തോട് ഉപമിക്കാം . സൂര്യനും, സൂര്യനെ നിശ്ചിത അകലങ്ങളില് ഭ്രമണം ചെയ്യുന്ന ഗ്രഹങ്ങളും ചേര്ന്നതാണല്ലോ സൌരയൂഥം . ഓരോ ഗ്രഹത്തിനും അതിന്റേതായ
ഭ്രമണപഥവുമുണ്ട്. സൂര്യനെ അണുവിനുള്ളിലെ ന്യൂക്ലിയസ്സായി സങ്കല്പ്പിച്ചാല് ഇലക്ട്രോണുകളെ സൂര്യനു ചുറ്റും ഭ്രമണം ചെയ്യുന്ന ഗ്രഹങ്ങളായി കരുതാം . അണുവില് ന്യൂക്ലിയസ്സിനും , ഇലക്ട്രോണുകള്ക്കുമിടയില് ധാരാളം
സ്പെയിസ് ഉണ്ടെന്നും മനസ്സിലാക്കണം . ഇലക്ട്രോണുകള് അണുകേന്ദ്രത്തെ ചുറ്റി സഞ്ചരിക്കുന്നത് വ്യത്യസ്ഥ ഊര്ജ്ജനിലകളിലാണ് . ഇങ്ങിനെയുള്ള സഞ്ചാരപഥത്തെ ഷെല് അഥവാ ഓര്ബിറ്റല് എന്നു പറയുന്നു . k . l . m . n . o
. p . q . ഇങ്ങിനെ പരമാവധി ഏഴ് ഷെല്ലുകളാണ് ഒരു ആറ്റത്തില് ഉണ്ടാവുക . ആദ്യത്തെ ഷെല് ആയ k യില് 2 ഇലക്ട്രോണുകളും പിന്നീട് യഥാക്രമം 8 , 8 , 18 , 18 , 32 , 32 എണ്ണം വീതം ഇലക്ട്രോണുകളാണ് l,m,n,o,p,q
എന്നീ ഷെല്ലുകളില് ഉണ്ടാവേണ്ടത് . ഇത് വളരെ പ്രധാനപ്പെട്ട ഒരു വസ്തുതയാണ് . കാരണം ആറ്റങ്ങള് അഥവാ മൂലകങ്ങള് സംയോജിച്ചു വിവിധ സംയുക്തങ്ങളും പദാര്ത്ഥങ്ങളും ഉണ്ടാവുന്നത് ഈയൊരു നീയമത്തിന്റെ അടിസ്ഥാനത്തിലാണ് .
ഉദാഹരണത്തിന് ഒന്നാമത്തെ മൂലകമായ (ആറ്റം) ഹൈഡ്രജനില് ഒ��ു പ്രോട്ടോണും ഒരു ഇലക്ട്രോണുമാണുള്ളത് . എല്ലാ മൂലകങ്ങളും അതിന്റെ ഷെല് അഥവാ ഓര്ബിറ്റല് പൂര്ത്തിയാക്കാന് ശ്രമിക്കുന്നു . പ്രകൃതിയില്
നടക്കുന്ന എല്ലാ രാസ പ്രവര്ത്തനങ്ങളുടെയും അടിസ്ഥാനം ഈ നിയമമാണ് . അപ്പോള് ഹൈഡ്രജന്റെ ആകെയുള്ള ഒരു ഷെല് പൂര്ത്തിയാക്കാന് ഒരു ഇലക്ട്രോണ് കൂടി ആവശ്യമുണ്ട് . അങ്ങിനെ ഒരു ഹൈഡ്രജന് മറ്റൊരു
ഹൈഡ്രജനെ കൂട്ടു പിടിക്കുകയും ആകെയുള്ള 2 ഇലക്ട്രോണുകളെ രണ്ട് ആറ്റങ്ങളും പങ്കു വെക്കുകയും ചെയ്യുന്നു .
അങ്ങിനെയാണ് ഹൈഡ്രജന് വാതകം( H2 ) ഉണ്ടാകുന്നത് . ഇനി നമ്മള് സാധാരണ പറയുന്ന ഓക്സിജന്റെ കാര്യമെടുക്കാം . ഓക്സിജന് ഒരു വാതകമാണെന്നും ജീവന്റെ നിലനില്പ്പിന് അത്യന്താപേക്ഷിതമാണെന്നും
അറിയാമല്ലോ . എട്ടാമത്തെ മൂലകമാണ് ഓക്സിജന് . അതായത് ഓക്സിജന് ആറ്റത്തില് 8 ഇലക്ട്രോണുകളാണുള്ളത്. ഇതില് ആദ്യത്തെ ഷെല് 2 ഇലക്ട്രോണ് കൊണ്ട് പുര്ത്തിയായി . രണ്ടാമത്തെ ഷെല്
പൂര്ത്തിയാകണമെങ്കില് 8 ഇലക്ട്രോണ് വേണമായിരുന്നു. എന്നാല് ഒന്നാമത്തെ ഷെല്ലില് രണ്ടെണ്ണം കഴിഞ്ഞാല് ബാക്കി 6 എണ്ണമല്ലെയുള്ളൂ . അപ്പോള് ഒരു ഓക്സിജന് മറ്റൊരു ഓക്സിജനെ കൂട്ടു പിടിച്ചു രണ്ടു
ഇലക്ട്രോണുകള് തല്ക്കാലത്തേക്ക് കടം വാങ്ങുകയും ഉടനെ തിരിച്ചു കൊടുക്കുകയും ചെയ്യുന്നു. ഇങ്ങിനെ പരസ്പരം കൊടുക്കുകയും വാങ്ങുകയും ചെയുമ്പോള് രണ്ട് ആറ്റങ്ങളുടെയും രണ്ടാമത്തെ ഷെല്ലുകള് 8 വിതം
ഇലക്ട്രോണുകള് കൊണ്ട് പൂര്ത്തിയാവുന്നു. ഇലക്ട്രോണുകള് സദാ സഞ്ചരിച്ചുകൊണ്ടിരിക്കുന്നു എന്ന് ഓര്ത്താല് ഈ പ്രതിഭാസം മനസ്സിലാക്കാന് വിഷമമില്ല . ഇങ്ങിനെയാണ് ഓക്സിജന് വാതകം ( O2 ) ഉണ്ടാവുന്നത് .
ഓക്സിജന് ഇങ്ങിനെ സംയുക്തമായിട്ടല്ലാതെ സിങ്കിള് എലമെന്റായി പ്രകൃതിയില് ഇല്ല . മറ്റൊരു ഓക്സിജന് സംയുക്തമാണ് ഓസോണ് (O3) . മൂന്ന് ഓക്സിജന് ആറ്റങ്ങള് ചേര്ന്നത്.
ഭൌമാന്തരീക്ഷത്തിന്റെ ഏറ്റവും മുകള്ത്തട്ടില് വ്യാപിച്ചു കിടക്കുന്ന ഓസോണ് വാതക വലയമാണ് , സൂര്യനില് നിന്ന് വികിരണം ചെയ്യപ്പെടുന്ന മാരകമായ അള്ട്രാ-വയലറ്റ് രശ്മി ആഗിരണം ചെയ്ത് ഭൂമിയിലെ
ജീവജാലങ്ങള്ക്ക് സംരക്ഷണം നല്കുന്നത് എന്ന വസ്തുത ഏവര്ക്കും അറിയാമല്ലോ .
നമ്മൾ ജീവിയ്ക്കുന്ന ഈ ഭൂമിയും സൂര്യനും കാറ്റും മഴയും ആകാശവും പ്രകൃതിയും പ്രപഞ്ചവും എല്ലാം എന്താണെന്ന് മനസ്സിലാക്കാൻ ആദ്യം അണുവിനെ (Atom) കുറിച്ച് പഠിക്കണം. കാരണം ഈ പ്രപഞ്ചത്തിൽ ജീവനുള്ളതും ഇല്ലാത്തതുമായ എല്ലാ പദാർഥങ്ങളുടെയും ഏറ്റവും അടിസ്ഥാന ഘടകം അണു ആണ്. സമുദ്രം ഉണ്ടായിട്ടുള്ളത് വളരെ സൂക്ഷ്മമായ ജലകണികൾ ചേർന്നിട്ടാണ്. പർവ്വതങ്ങൾ ഉണ്ടായത് നേരിയ മൺതരികൾ ചേർന്നിട്ടാണ്. കൊടുങ്കാറ്റുകൾ ഉണ്ടാകുന്നത് തീരെ ചെറിയ വായുതന്മാത്രകൾ ചേർന്നിട്ടാണ്. അണുക്കൾ ചേർന്നിട്ടാണ് ഇക്കാണുന്ന സർവ്വവും ഉണ്ടായിട്ടുള്ളത്. അത്കൊണ്ട് പ്രകൃതിയെ പഠിക്കാൻ ശ്രമിക്കുന്ന ആരും ആദ്യം അണു എന്താണു എന്ന് മനസ്സിലാക്കണം. അക്ഷരമാലകൾ ചേർന്നിട്ടാണല്ലൊ ഭാഷയും ഭാഷയിലെ അസംഖ്യം വാക്കുകളും ഉണ്ടാകുന്നത്. അത് പോലെ അണുക്കൾ ചേർന്നിട്ടാണു ഈ പ്രപഞ്ചത്തിലെ സർവ്വവും ഉണ്ടായിട്ടുള്ളത്.
ഏത് പദാർത്ഥവും ചെറുതാക്കാൻ സാധിക്കും. അങ്ങനെ ചെറുതാക്കിയാൽ ഏറ്റവും അവസാനത്തെ കണികയാണ് അണു. പ്രകൃതിയിൽ 92 തരം അണുക്കളാണുള്ളത്. പിന്നെയും 20ലധികം അണുക്കൾ ശാസ്ത്രജ്ഞന്മാർക്ക് ലബോറട്ടറിയിൽ നിർമ്മിച്ചെടുക്കാൻ സാധിക്കും. ഏറ്റവും ചെറിയ ആറ്റം (ഇനി ആറ്റം എന്ന് പറയാം) ഒന്നാമത്തെ ഹൈഡ്രജനാണു. ഏറ്റവും വലുത് തൊണ്ണൂറ്റിരണ്ടാമത്തെ യുറേനിയവും. ഒന്ന് മുതൽ തൊണ്ണൂറ്റിരണ്ട് വരെ ആറ്റങ്ങളെ ക്രമപ്പെടുത്തിയിരിക്കുന്നത് ആറ്റത്തിനുള്ളിലെ പ്രോട്ടോണുകളുടെ എണ്ണത്തെ അടിസ്ഥാനമാക്കിയിട്ടാണ്. ആറ്റത്തിന്റെ ഉള്ളിൽ പ്രോട്ടോൺ , ന്യൂട്രോൺ , എലക്ട്രോൺ ഇങ്ങനെ മൂന്ന് തരം കണികകൾ ഉണ്ട്. പിന്നെയും ചില സൂക്ഷ്മകണികകൾ ഉണ്ട്. അതിനെ പറ്റി തൽക്കാലം പഠിക്കേണ്ട. അത് കൂടുതൽ സങ്കീർണ്ണമാണു. തുടക്കത്തിൽ ഈ മൂന്ന് അടിസ്ഥാനകണികൾ ചേർന്നതാണു ആറ്റം എന്ന് മനസ്സിൽ വയ്ക്കാം.
ആറ്റത്തിനു മധ്യത്തിൽ പ്രോട്ടോണും ന്യൂട്രോണും ചേർന്ന ന്യൂക്ലിയസ്സും , ആ ന്യൂക്ലിയസ്സിനെ ചുറ്റി ഭ്രമണം ചെയ്യുന്ന എലക്ട്രോണും ഉണ്ട്. പ്രോട്ടോണിന് പോസിറ്റീവ് ചാർജ്ജും എലക്ട്രോണിന് നെഗറ്റീവ് ചാർജ്ജും ആണുള്ളത്. ന്യൂട്രോണിന് ചാർജ്ജ് ഇല്ല. ഒന്നാമത്തെ ആറ്റം ഹൈഡ്രജനിൽ ന്യൂക്ലിയസ്സിൽ ഒരു പ്രോട്ടോണും ഒരു എലക്ട്രോണും ആണുള്ളത്. ന്യൂട്രോൺ ഇല്ല. എല്ലാ ആറ്റങ്ങളിലും പ്രോട്ടോണിന്റെ എണ്ണവും എലക്ട്രോണിന്റെ എണ്ണവും തുല്യമായിരിക്കും. അത്കൊണ്ടാണു നാം കാണുന്ന ഒരു പദാർഥത്തിനും ചാർജ്ജ് ഇല്ലാത്തത്. എന്നാൽ ന്യൂട്രോണിന്റെ എണ്ണം വ്യത്യസ്തമായിരിക്കും.
ഹൈഡ്രജൻ ആറ്റത്തിൽ ന്യൂട്രോൺ ഇല്ല എന്ന് പറഞ്ഞല്ലൊ. പക്ഷെ ന്യൂട്രോൺ ഉള്ള ഹൈഡ്രജൻ ആറ്റങ്ങളും പ്രകൃതിയിൽ ഉണ്ട്. അതിനെ പറ്റി പിന്നീട് മനസ്സിലാക്കാം. സാധാരണഗതിയിൽ ഹൈഡ്രജൻ ആറ്റത്തിൽ മാത്രം ന്യൂട്രോൺ ഇല്ല. രണ്ടാമത്തെ ആറ്റം ഹീലിയമാണ്. ഹീലിയത്തിൽ രണ്ട് പ്രോട്ടോണും രണ്ട് ന്യൂട്രോണും രണ്ട് എലക്ട്രോണും ഉണ്ട്. അങ്ങനെ മൂന്നാമത്തെ ആറ്റം ലീത്തിയത്തിൽ lithium (Li) മൂന്ന് പ്രോട്ടോണും മൂന്ന് ന്യൂട്രോണും മൂന്ന് എലക്ട്രോണും ആണുള്ളത്. തൊണ്ണൂറ്റിരണ്ടാമത്തെ യുറേനിയത്തിൽ 92 പ്രോട്ടോണും 92 എലക്ട്രോണും 146 ന്യൂട്രോണും ആണുള്ളത്. 146ൽ കൂടുതൽ ന്യൂട്രോൺ ഉള്ള യുറേനിയവും ഉണ്ട്. ഐസോടോപ്പ് എന്ന് പറയുന്ന ഇത്തരം ആറ്റങ്ങളെ കുറിച്ച് , ഹൈഡ്രജനെ പറ്റി പറഞ്ഞത് പോലെ തന്നെ പിന്നീട് മനസ്സിലാക്കാം.
ഒരു ആറ്റത്തിൽ എത്ര പ്രോട്ടോൺ ഉണ്ടോ അതാണു ആ ആറ്റത്തിന്റെ ക്രമനമ്പർ സൂചിപ്പിക്കുന്നത്. പ്രോട്ടോണിന്റെ എണ്ണം കൂടുമ്പോൾ ആറ്റത്തിന്റെ ഭാരം കൂടുന്നു. ഏറ്റവും ഭാരം കുറഞ്ഞ ആറ്റം ഹൈഡ്രജനും ഏറ്റവും ഭാരം കൂടിയ ആറ്റം യുറേനിയവും ആണു. യുറേനിയത്തേക്കാളും ഭാരം കൂടിയ ആറ്റങ്ങൾ കൃത്രിമമായി ലബോറട്ടറിയിൽ നിർമ്മിക്കുമെങ്കിലും അത്തരം ആറ്റങ്ങളുടെ ആയുസ്സ് ക്ഷണികമാണു. ഭാരം കൂടിയ ആറ്റങ്ങൾ പെട്ടെന്ന് പിളർന്ന് സ്ഥിരതയുള്ള ചെറിയ ആറ്റങ്ങളായി മാറാൻ ശ്രമിക്കും. പ്രോട്ടോണിന്റെ എണ്ണത്തിനു തുല്യമായ എലക്ട്രോണും ഉണ്ടാകുന്നത് കൊണ്ട് ആറ്റങ്ങൾക്ക് ചാർജ്ജ് ഇല്ല എന്ന് ആദ്യമേ പറഞ്ഞല്ലൊ. പ്രോട്ടോണും ന്യൂട്രോണും ചേർന്നതാണു ഒരു ആറ്റത്തിന്റെ ഭാരം അല്ലെങ്കിൽ മാസ്സ്. എലക്ട്രോണിനു ഭാരം പറയാൻ മാത്രം ഇല്ല.
ആറ്റത്തിന്റെ മദ്യത്തിലെ ന്യൂക്ലിയസ്സിലാണു പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ചേർന്ന് നിൽക്കുന്നത്. ന്യൂക്ലിയസ്സിനെ ചുറ്റി എലക്ട്രോണുകൾ ഭ്രമണം ചെയ്യുന്നു. ആറ്റത്തിൽ ന്യൂക്ലിയസ്സിനും എലക്ട്രോണുകളുടെ ഭ്രമണപഥത്തിനും ഇടയിൽ സൗരയൂഥത്തിൽ സൂര്യനും ഭൂമിക്കും എന്ന പോലെ ഇടവെളിയുണ്ട്. ആറ്റത്തെ നമുക്ക് കണ്ണ് കൊണ്ട് കാണാൻ കഴിയാത്തത്കൊണ്ട് ആറ്റത്തിന്റെ ഘടന മനസ്സിൽ സങ്കൽപ്പിക്കാനേ കഴിയൂ. ആറ്റത്തെ കുറിച്ച് ഇത്രയും മനസ്സിലാക്കിയാൽ പിന്നെ പ്രധാനമായി മനസ്സിലാകേണ്ടത്, ആറ്റത്തിന്റെ ഉൾഭാഗത്ത് പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ചേർന്ന ന്യൂക്ലിയസ്സിനെ ചുറ്റി എലക്ട്രോണുകൾ ഭ്രമണം ചെയ്യുന്ന രീതിയാണു. അതാണു ഏറ്റവും പ്രധാനവും നിർണ്ണായകവും. എലക്ട്രോണുകളുടെ ഈ സഞ്ചാരപഥത്തിന്റെ പ്രത്യേകതയിൽ നിന്നാണു എലക്ട്രോണിക്സ് തന്നെ ആരംഭിക്കുന്നത്. അതിനെ പറ്റി അടുത്ത പോസ്റ്റിൽ പറയാം.
അണു അഥവാ ആറ്റം - 2
ജീവൻ ഉള്ളതും ഇല്ലാത്തതുമായ എല്ലാ പദാർഥങ്ങളുടെയും ഏറ്റവും ചെറിയ യൂനിറ്റ് അണു ആണെന്നും , അണുവിൽ പ്രോട്ടോൺ, ന്യൂട്രോൺ , എലക്ട്രോൺ എന്ന് മൂന്ന് കണികൾ ഉണ്ടെന്നും നമ്മൾ മനസ്സിലാക്കി. എലക്ട്രോണിന് നെഗറ്റീവ് ചാർജ്ജാണുള്ളത്. എലക്ട്രോൺ പിന്നെയും ചെറുതാക്കാൻ പറ്റില്ല. പോസിറ്റീവ് ചാർജ്ജ് ഉള്ള പ്രോട്ടോണും ചാർജ്ജ് ഇല്ലാതെ ന്യൂട്രൽ ആയ ന്യൂട്രോണും പിന്നെയും ചെറിയ കണികകളായി മാറും. അത് ഇപ്പോൾ പഠിക്കേണ്ട. നമ്മുടെ ശരീരം കോടാനുകോടി അണുക്കൾ ചേർന്ന് ഉണ്ടായതാണ്. അങ്ങനെ നാം കാണുന്ന എന്തും അണുക്കൾ ചേർന്ന് ഉണ്ടായതാണ്. അണു എന്നത് എല്ലാറ്റിന്റെയും ഏറ്റവും ചെറിയ യൂനിറ്റിന് പൊതുവായി പറയുന്ന പേരാണ്. വിവിധ അണുക്കളുണ്ട്. ഓരോ അണുവിലും ഉള്ള പ്രോട്ടോണിന്റെ എണ്ണതിനനുസരിച്ച് വ്യത്യാസപെടുന്ന അണുക്കളെ മൂലകം (Element) എന്ന് പറയും. ഉദാഹരണത്തിനു ഒരു പ്രോട്ടോൺ ഉള്ള മൂലകം ഹൈഡ്രജൻ. രണ്ട് പ്രോട്ടോൺ ഉള്ള മൂലകം ഹീലിയം. ആറ് പ്രോട്ടോൺ ഉള്ള മൂലകം കാർബൺ, എട്ട് പ്രോട്ടോൺ ഉള്ള മൂലകം ഓക്സിജൻ എന്നിങ്ങനെ. പ്രോട്ടോണുകളുടെ എണ്ണമാണു ഒരോ മൂലകത്തെയും നിർണ്ണയിക്കുന്നത് എന്ന് സാരം.
പ്രകൃതിയിൽ തൊണ്ണൂറോളം മൂലകങ്ങൾ മാത്രമാണുള്ളത്. മൂലകങ്ങൾ ചേർന്ന് സംയുക്തങ്ങൾ ഉണ്ടാകുന്നു. നമ്മൾ കാണുന്ന എന്തും ഇങ്ങനെ മൂലകങ്ങൾ ചേർന്നുണ്ടായ സംയുക്തങ്ങളാണു. ഉദാഹരണത്തിനു വെള്ളം. വെള്ളത്തിന്റെ ഏറ്റവും ചെറിയ കണികയെ ജല തന്മാത്ര (Molecule) എന്ന് പറയും. അതായത് ഏത് വസ്തുവിന്റെയും ഏറ്റവും ചെറിയ യൂനിറ്റ് തന്മാത്രയാണ്. മൂലകങ്ങൾ ചേർന്ന് തന്മാത്രകൾ ഉണ്ടാകുന്നു. തന്മാത്രകൾ ചേർന്ന് കോശങ്ങൾ ഉണ്ടാകുന്നു. കോശങ്ങൾ ചേർന്ന് ജീവികളുടെ ശരീരങ്ങളും ചെടികളും വൃക്ഷങ്ങളും ഉണ്ടാകുന്നു. ജലതന്മാത്രകൾ ചേർന്ന് വെള്ളവും പുഴകളും സമുദ്രങ്ങളും ഉണ്ടാകുന്നു. വായുതന്മാത്രകൾ ചേർന്ന് നമുക്ക് ചുറ്റുമുള്ള അന്തരീഷം ഉണ്ടാകുന്നു. അന്തരീക്ഷത്തിലെ വായുതന്മാത്രകൾ ചലിക്കുമ്പോൾ കാറ്റ് ഉണ്ടാകുന്നു. രണ്ട് ഹൈഡ്രജൻ മൂലകങ്ങളും ഒരു ഓക്സിജൻ മൂലകവും ചേർന്ന് ഒരു ജലതന്മാത്ര ഉണ്ടാകുന്നു. രണ്ട് ഓക്സിജൻ മൂലകങ്ങൾ ചേർന്ന് ഒരു ഓക്സിജൻ വായുതന്മാത്ര ഉണ്ടാകുന്നു.
വ്യത്യസ്ത മൂലകങ്ങൾ ചേർന്നും ഒരേ മൂലകങ്ങൾ ചേർന്നും തന്മാത്രകൾ ഉണ്ടാകും. അതാണു വെള്ളത്ത്ന്റെയും ഓക്സിജൻ വായുവിന്റെയും ഉദാഹരണം പറഞ്ഞത്. എന്ത്കൊണ്ടാണ് ഇങ്ങനെ മൂലകങ്ങൾ യോജിക്കുന്നത്? അത് മനസ്സിലാക്കാനാണു നമ്മൾ അണുവിലെ എലക്ട്രോണുകളുടെ ഘടനെ പറ്റി പഠിക്കേണ്ടി വരുന്നത്. ഒന്നാമത്തെ മൂലകമായ ഹൈഡ്രജനിൽ ഒരു എലക്ട്രോണും തൊണ്ണൂറ്റിരണ്ടാമത്തെ മൂലകമായ യുറേനിയത്തിൽ 92 എലക്ട്രോണുകളും ആണുള്ളത് എന്ന് നേരത്തെ പഠിച്ചല്ലൊ. ഏത് മൂലകത്തിലും പ്രോട്ടോണിന്റെയും എലക്ട്രോണിന്റെയും എണ്ണം തുല്യമായിരിക്കും എന്നും പഠിച്ചതാണു. മൂലകത്തിൽ പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ചേർന്ന ന്യൂക്ലിയസ്സിനെ എലക്ട്രോണുകൾ വിവിധ ഭ്രമണപഥങ്ങളിൽ ചുറ്റിക്കൊണ്ടിരികുന്നു. ഓരോ ഭ്രമണപഥത്തിനും ഷെൽ എന്നാണു പറയുക. ഒരു ഷെല്ലിൽ ഇത്ര എലക്ട്രോണുകൾ മാത്രമേ പാടുള്ളൂ എന്നുണ്ട്. ഓരോ ഷെല്ലിനും സബ്-ഷെല്ലും ഉണ്ട്. അത് പിന്നെ പഠിക്കാം. ഷെല്ലുകളെ ഇംഗ്ലീഷ് അക്ഷരമാലയിലെ K, L, M, N, O, P എന്ന അക്ഷരങ്ങൾ കൊണ്ടാണ് അറിയപ്പെടുക. ചിത്രം നോക്കുക.
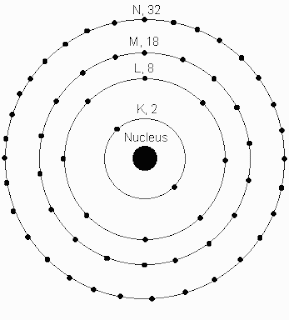
ഉദാഹരണത്തിന് ഒന്നാമത്തെ K ഷെല്ലിൽ 2 എലക്ട്രോൺ ആണുള്ളത്. രണ്ടാമത്തെ L ഷെല്ലിൽ 8 എലക്ട്രോണും മൂന്നാമത്തെ M ഷെല്ലിൽ 18 എലക്ട്രോണും നാലാമത്തെ N ഷെല്ലിൽ 32 എലക്ട്രോണുകളും ആണുള്ളത്. ഈ 2, 8,18,32 എന്നത് ഒരു മാന്ത്രിക സഖ്യ പോലെയാണു. സബ്-ഷെല്ലുകളെ പറ്റി പറഞ്ഞാൽ ഇതിൽ മാറ്റം വരും. എന്നാൽ തുടക്കത്തിൽ അതും പറഞ്ഞാൽ ഗ്രഹിക്കാൻ പ്രയാസമുണ്ടാകും എന്നത് കൊണ്ട് തൽക്കാലം വിടുകയാണ്. മൂലകങ്ങൾക്ക് അതാതിന്റെ എലക്ട്രോൺ ഷെൽ പൂർത്തിയാക്കേണ്ടതുണ്ട്. അങ്ങനെ മൂലകങ്ങൾ തമ്മിൽ എലക്ട്രോണുകളെ കൊടുക്കുകയും വാങ്ങുകയും പങ്ക് വയ്ക്കുകയും ചെയ്യുന്നു. എന്നിട്ട് അതാത് മൂലകങ്ങളിലെ എലക്ട്രോൺ ഷെല്ലുകൾ നിറച്ച് ഭദ്രമാക്കുന്നു.
ഉദാഹരണത്തിനു ഹൈഡ്രജൻ അണുവിൽ ഒരു പ്രോട്ടോണും ഒരു എലക്ട്രോണും മാത്രമാണുള്ളത്. അതായത് ഹൈഡ്രജന്റെ ആകെയുള്ള ഒരു ഷെല്ലിൽ (K) ഒരൊറ്റ എലക്ട്രോൺ മാത്രമേയുള്ളൂ. ഒരു എലക്ട്രോൺ കൂടി കിട്ടിയാൽ ആ ഷെൽ പൂർത്തിയാക്കാമായിരുന്നു. ഓക്സിജന്റെ അണുസഖ്യ 8 ആണ്. അതിന്റെ അർഥം ഓക്സിജൻ മൂലകത്തിൽ 8 എലക്ട്രോൺ ഉണ്ടെന്നും ഒന്നാമത്തെ K എന്ന ഷെല്ലിൽ രണ്ട് എലക്ട്രോണുകളും L എന്ന രണ്ടാമത്തെ ഷെല്ലിൽ 6 എലക്ട്രോണുകളും ആണുള്ളത് എന്നാണു. അതായത് ഓക്സിജന് രണ്ടാമത്തെ ഷെൽ പൂർത്തിയാക്കിയേ പറ്റൂ. അതിന് രണ്ട് എലക്ട്രോണുകൾ വേണം. അങ്ങനെ ഓക്സിജൻ മൂലകം രണ്ട് ഹൈഡ്രജൻ മൂലകങ്ങളുമായി യോജിക്കുന്നു. ഇപ്പോൾ എന്തായി? രണ്ട് ഹൈഡ്രജൻ ആറ്റത്തിലെ രണ്ട് എലക്ട്രോണുകളെ കൊണ്ട് ഓക്സിജൻ അതിന്റെ രണ്ടാമത്തെ ഷെൽ പൂർത്തിയാക്കുന്നു. എലക്ട്രോണുകൾ ചുമ്മാ നിൽക്കുകയല്ല. സഞ്ചരിച്ചുകൊണ്ടേയിരിക്കുന്നു. ആ സഞ്ചാരത്തിനിടയിൽ ഓക്സിജന്റെ രണ്ടാം ഷെല്ലിലെ എലക്ട്രോണുകൾ ഹൈഡ്രജനിലേക്കും , ഹൈഡ്രജന്റെ ഒന്നാം ഷെല്ലിലെ എലക്ട്രോൺ ഓക്സിജനിലേക്കും പോയും വന്നും , രണ്ട് ഹൈഡ്രജൻ അണുക്കളും ഒരു ഓക്സിജൻ അണുവും തൃപ്തിയാകുന്നു എന്ന് മാത്രമല്ല്ല പ്രപഞ്ചത്തിലെ അത്ഭുതം എന്ന് പറയാവുന്ന ജലം എന്ന ദ്രാവകം ഉണ്ടാവുകയും ചെയ്യുന്നു.
മൂലകങ്ങൾ വെറുതെ സംയോജിച്ച് തന്മാത്രകൾ ഉണ്ടാവുകയല്ല, അതിലെ എലക്ട്രോൺ ഷെൽ പൂർത്തിയാക്കി ഊർജ്ജനില സുസ്ഥിരമാക്കാൻ വേണ്ടിയാണു യോജിക്കുന്നത് എന്ന് മനസ്സിലാക്കുക. ഭാരം കൂടിയ മൂലകങ്ങൾ സ്വയം പിളർന്ന് രണ്ട് ലഘുമൂലകങ്ങളായി രൂപാന്തരപ്പെട്ടാണു സുസ്ഥിരത കൈവരിക്കുക. അതൊക്കെ പിന്നീട് വിശദീകരിക്കാം. തന്മാത്രകൾ ഉണ്ടാവുകയും , ഉള്ള തന്മാത്രകൾ വിഘടിക്കുകയും ചെയ്യുക എന്ന രാസപ്രവർത്തനം സദാ നടന്നുകൊണ്ടിരിക്കുന്നു. രണ്ട് തരം പ്രവർത്തനങ്ങളാണ് പ്രകൃതിയിൽ നടക്കുന്നത്. രാസപ്രവർത്തനവും ഭൗതികപ്രവർത്തനവും. അത്കൊണ്ടാണ് രസതന്ത്രവും ഊർജ്ജതന്ത്രവും എന്ന രണ്ട് ശാസ്ത്രശാഖകൾ പ്രധാനമാകുന്നത്. നമ്മൾ എന്തെങ്കിലും കത്തിക്കുമ്പോൾ ആ പദാർഥത്തിലെ കാർബൺ മൂലകവും വായുവിലെ ഓക്സിജൻ തന്മാത്രയും യോജിച്ച് കാർബൺ ഡൈഓക്സൈഡും പുകയും വെളിച്ചവും ചൂടും ഉണ്ടാകുന്നതാണു രാസപ്രവർത്തനത്തിന്റെ ലളിതമായ ഉദാഹരണം. വെള്ളം തിളപ്പിക്കുമ്പോൾ അത് നീരാവിയായി മാറുന്നതാണ് ഭൗതികപ്രവർത്തനത്തിന്റെ ഒരുദാഹരണം. ആദ്യത്തേതിൽ പദാർത്ഥത്തിനു രാസമാറ്റവും രണ്ടാമത്തേതിൽ ഭൗതികമാറ്റവും സംഭവിക്കുന്നു.
ഏറ്റവും ചെറിയ കണികയ്ക്ക് അണു എന്ന് പൊതുവിൽ പറയുന്നത് പോലെ പ്രപഞ്ചത്തിൽ ഉള്ള എല്ലാറ്റിനും പൊതുവായി പദാർഥം അഥവാ ദ്രവ്യം എന്ന് പറയുന്നു. പദാർഥം മൂന്ന് അവസ്ഥകളിലാണു സ്ഥിതി ചെയ്യുക. ഖരം, ദ്രാവകം, വാതകം എന്നിവയാണ് ആ മൂന്ന് അവസ്ഥകൾ. നാലമതായി ഒരവസ്ഥയുണ്ട് പ്ലാസ്മ. ഭൂമിയുടെ മധ്യത്തിൽ പദാർഥം പ്ലാസ്മ എന്ന അവസ്ഥയിലാണു സ്ഥിതി ചെയ്യുന്നത്. അതിഭയങ്കരമായ ചൂടാണതിനു കാരണം. ഏത് പദാർഥത്തെയും ഒരവസ്ഥയിൽ നിന്ന് മറ്റൊന്നിലേക്ക് മാറ്റാൻ കഴിയും. വെള്ളം ദ്രാവകാവസ്ഥയിൽ ആണെങ്കിലും അത് നീരാവി എന്ന വാതകാവസ്ഥയിലേക്കും ഐസ്കട്ട എന്ന ഖരാവസ്ഥയിലേക്കും മാറുന്നത് നമ്മൾ കാണുന്നതാണല്ലൊ.

